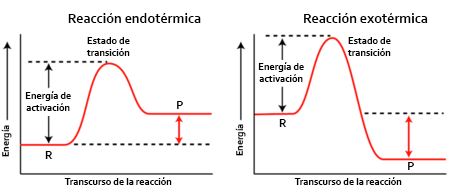
La combustión es el proceso químico por el cual una sustancia, llamada combustible, reacciona con el oxígeno. En general, esta reacción es fuertemente exotérmica, desprendiéndose energía en forma de calor, luz o sonido.
Esta reacción no tiene lugar de forma espontánea, sino que, para que comience, ha de aportarse energía a través de una llama o de una chispa eléctrica. Eso si, una vez empezada, continúa por sí sola hasta que se agote el combustible o el oxígeno.
Es una reacción de gran importancia, tanto en la naturaleza como para la actividad humana, ya que es la forma en que los seres vivos y los artefactos humanos obtienen de forma muy mayoritaria su energía. Reacciones de combustión particularmente importantes son:
La combustión del carbono. Su ecuación química es la siguiente: C(s) + O2(g) → CO2(g). El producto es dióxido de carbono y se desprende energía lumínica y calorífica. Cuando esta reacción tiene lugar con poco oxígeno, la reacción es entonces: C(s) + ½O2(g) → CO(g), formándose monóxido de carbono, un gas venenoso y muy peligroso.
La combustión de hidrocarburos (compuestos cuya base es carbono e hidrógeno). En esta reacción se forma CO2 y vapor de agua. Es la reacción que tiene lugar en la combustión de los combustibles fósiles (carbón y petróleo), fuente básica de obtención de energía en nuestra sociedad. Un ejemplo de esta reacción es la combustión del metano:
| CH4(g) + 2O2(g) → CO2 (g) + 2 H2O (g) |
- La combustión de la glucosa en el cuerpo humano. La glucosa, procedente de la digestión de ciertos alimentos o de la transformación de otras sustancias, reacciona con el oxígeno presente en las células, produciendo CO2, agua y liberando energía. Esta reacción es lo que se conoce como respiración, cuya importancia no es necesario recordar.
Un punto importante a destacar, es que los productos de la combustión, fundamentalmente el dióxido de carbono, tienen una gran incidencia cuando son liberados al medio ambiente, ya que este gas es el que produce mayor efecto invernadero